L'acide borofluorique comme catalyseur : applications et mécanismes de formation du sel de borofluorure
Acide borofluorique (HBF)4) est un acide inorganique hautement réactif qui joue un rôle important dans la chimie et l'industrie modernes. Lorsqu'il est utilisé comme catalyseur, le HBF4 facilite une grande variété de réactions, en particulier celles qui impliquent la formation de sels de borofluorure, une classe de composés utiles dans diverses applications industrielles. Dans cet article, nous explorerons les applications spécifiques de l'acide borofluorique en tant que catalyseur, son rôle dans la facilitation des réactions chimiques et les mécanismes sous-jacents qui en font un catalyseur aussi polyvalent et efficace.
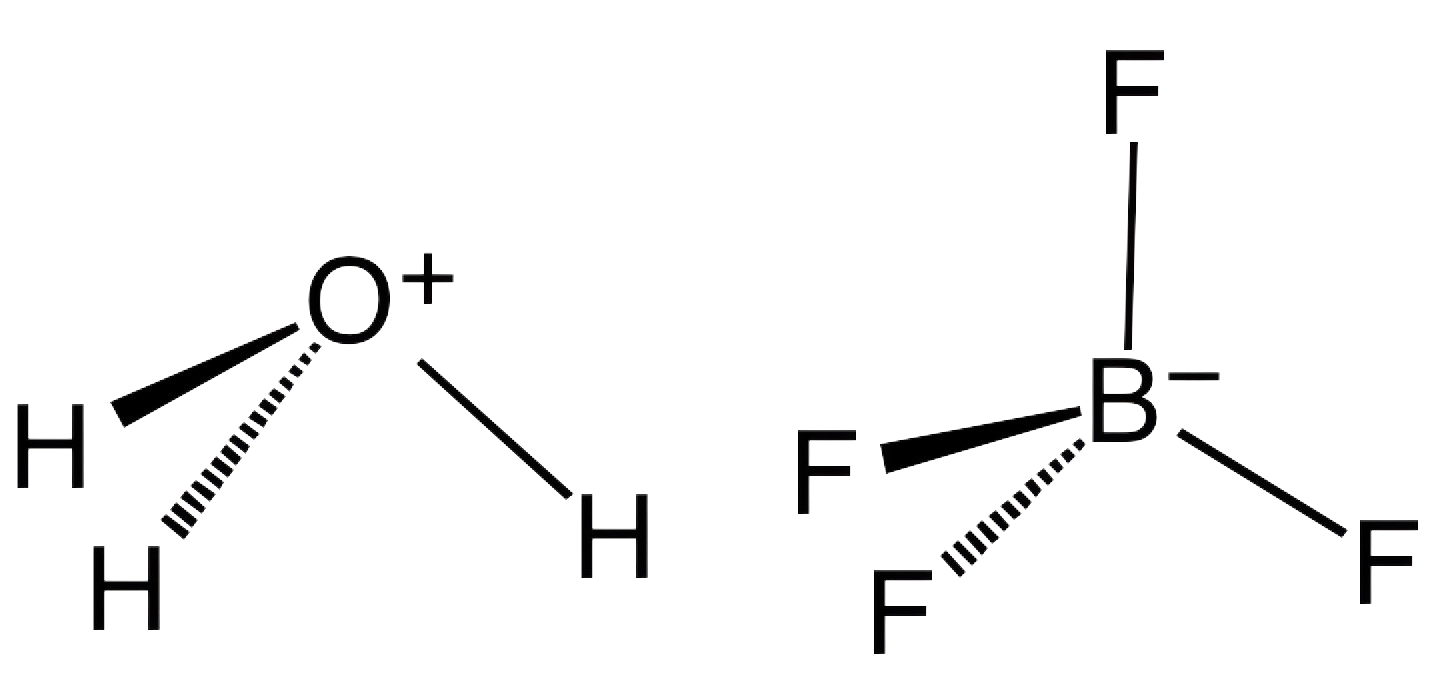
1. Qu’est-ce que l’acide borofluorique et comment fonctionne-t-il comme catalyseur ?
Acide borofluorique, de formule chimique HBF4, est un composé constitué d'hydrogène, de bore et de fluor. C'est un acide fort qui se dissocie en solution pour libérer un proton (H+) et l'anion tétrafluoroborate (BF4-). La combinaison unique de bore et de fluor dans sa structure lui confère des propriétés catalytiques distinctes, en particulier dans les réactions où des espèces à base de fluor ou la chimie du bore sont impliquées.
En tant que catalyseur, l'acide borofluorique fonctionne en favorisant certaines réactions chimiques sans être consommé dans le processus. Il peut activer les molécules en donnant des protons (agissant comme un acide de Brønsted) ou en acceptant des paires d'électrons (agissant comme un acide de Lewis). Ces propriétés font du HBF4 particulièrement utile dans diverses réactions, y compris la formation de sels de borofluorure, qui ont de vastes applications industrielles.
2. Applications de l'acide borofluorique comme catalyseur
2.1 Formation de sels de borofluorure
L’une des utilisations les plus courantes de l’acide borofluorique est la synthèse de sels de borofluorure, tels que le tétrafluoroborate de sodium (NaBF4), tétrafluoroborate de potassium (KBF4) et le tétrafluoroborate d'ammonium (NH4BF4). Ces sels sont essentiels dans plusieurs processus chimiques et sont formés en neutralisant l'acide borofluorique avec une base appropriée. La réaction générale est la suivante :
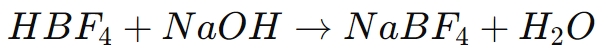
Dans ce processus, l'acide borofluorique donne un proton à la base, formant de l'eau et laissant derrière lui l'anion tétrafluoroborate (BF4-), qui s'associe ensuite à l'ion métallique (par exemple, Na+) pour former un sel de borofluorure.
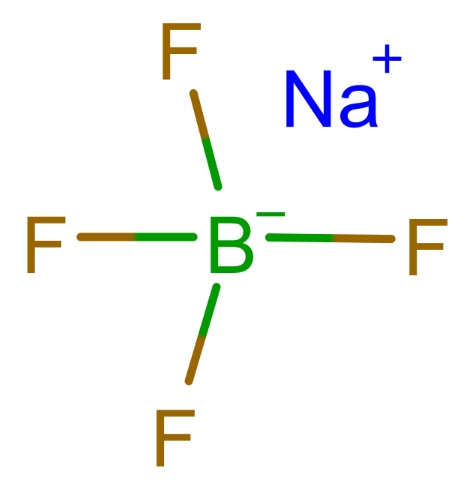
Ces sels de borofluorure sont utilisés dans divers domaines, notamment :
● Électrochimie :Utilisé comme électrolytes dans les batteries lithium-ion et les processus de galvanoplastie.
● Chimie des polymères : Agir comme initiateurs dans les réactions de polymérisation.
● Fluoration : Utilisé pour introduire des atomes de fluor dans des composés organiques, améliorant ainsi leur stabilité et leur réactivité.
2.2 Synthèse organique et catalyse
L'acide borofluorique joue également un rôle essentiel dans la synthèse organique, notamment dans l'activation des réactifs électrophiles. Lorsqu'il est utilisé comme catalyseur, le HBF4 peut accélérer des réactions telles que l'alkylation de Friedel-Crafts, l'acylation et d'autres réactions de substitution électrophile. Le mécanisme implique généralement les propriétés de l'acide de Lewis du HBF4, où il se coordonne avec les espèces riches en électrons, améliorant leur réactivité et favorisant la formation de nouvelles liaisons.
Par exemple, dans leAlkylation de Friedel-Crafts, HBF₄active les halogénures d'alkyle, facilitant l'addition de groupes alkyles aux cycles aromatiques. La réaction générale pour un tel procédé est la suivante :
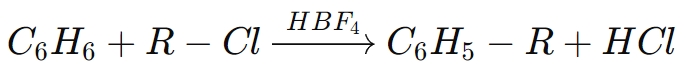
Dans cette réaction, l’acide borofluorique agit comme catalyseur pour faciliter l’alkylation du benzène avec un chlorure d’alkyle, produisant un composé aromatique alkylé.
2.3 Polymérisation et oligomérisation
HBF4 L'acide borofluorique est également un catalyseur efficace pour les réactions de polymérisation. Il est notamment utilisé pour initier la polymérisation du styrène et d'autres monomères, ce qui conduit à la formation de matériaux polymères précieux comme le polystyrène. L'acide borofluorique peut activer la double liaison dans le monomère, permettant la croissance des chaînes polymères et la formation du polymère.
Par exemple, dans la polymérisation du styrène (C8H8):
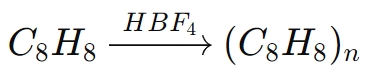
Dans cette réaction, HBF4initie la polymérisation en donnant un proton à la molécule de styrène, générant un carbocation réactif, qui propage ensuite la chaîne polymère.
De plus, l’acide borofluorique peut catalyseroligomérisation, le processus par lequel de petites molécules (oligomères) forment des chaînes plus longues sans polymérisation complète. Ceci est important dans la production de matériaux spécialisés utilisés dans les revêtements et les adhésifs.
2.4 Applications électrochimiques et de batteries
Dans le domaine de l'électrochimie, l'acide borofluorique est largement utilisé pour créer des sels de borofluorure qui servent d'électrolytes dans les batteries lithium-ion et d'autres types de batteries. L'utilisation de sels de borofluorure dans les batteries améliore leur conductivité ionique et leur stabilité, ce qui les rend particulièrement adaptées à une utilisation dans les systèmes de stockage d'énergie.
Par exemple, le tétrafluoroborate de lithium (LiBF4) est couramment utilisé comme électrolyte dans les batteries lithium-ion en raison de sa conductivité ionique élevée et de sa stabilité à haute tension.
Le rôle de l'acide borofluorique dans les processus électrochimiques s'étend à la galvanoplastie des métaux, où les sels de borofluorure agissent comme des solutions électrolytiques qui facilitent le dépôt de métaux tels que le cuivre, l'or et l'étain. L'utilisation de l'acide borofluorique dans ce contexte permet de créer des revêtements plus uniformes sur les métaux, ce qui en fait un composant essentiel dans des industries telles que l'électronique et la finition des métaux.
2.5 Fluoration des composés organiques
Une autre application importante de l'acide borofluorique en tant que catalyseur est dans les réactions de fluoration. La capacité d'incorporer des atomes de fluor dans des molécules organiques est précieuse dans la production de produits pharmaceutiques, de produits agrochimiques et de matériaux spéciaux. L'acide borofluorique peut activer des sources de fluor, telles que le gaz fluoré ou les composés contenant du fluor, leur permettant de réagir avec des substrats organiques.
Par exemple, dans la fluoration d’un composé organique (RX) :
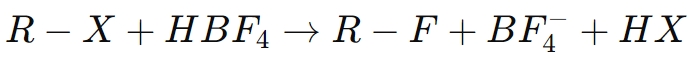
Ici, l’acide borofluorique facilite la substitution d’un atome d’halogène par du fluor, améliorant ainsi les propriétés du composé résultant, telles que sa stabilité chimique et sa résistance à la dégradation.
3. Mécanisme de catalyse par l'acide borofluorique
L'activité catalytique de l'acide borofluorique peut s'expliquer par sa capacité à fonctionner à la fois comme unAcide de Brønsted et unAcide de Lewis:
● Acide de Brønsted : En tant que donneur de protons, l'acide borofluorique peut protoner les substrats, augmentant ainsi leur électrophilie et les rendant plus réactifs dans les réactions ultérieures. Cela est particulièrement utile dans des réactions comme la substitution nucléophile, où un nucléophile riche en électrons attaque un substrat électrophile.
● Acide de Lewis : L'acide borofluorique agit comme un acide de Lewis en acceptant des paires d'électrons provenant d'espèces nucléophiles, activant ainsi les électrophiles et facilitant diverses réactions de substitution et d'addition. Cela est particulièrement évident dans des réactions comme l'alkylation de Friedel-Crafts, où HBF₄ se coordonne avec les halogénures d'alkyle, les rendant plus réactifs avec les composés aromatiques.
Grâce à ces mécanismes, l’acide borofluorique peut réduire l’énergie d’activation des réactions, augmenter les taux de réaction et améliorer le rendement des produits souhaités.
4. Avantages et défis de l'utilisation de l'acide borofluorique
4.1 Avantages
● Efficacité :L'acide borofluorique accélère les réactions en réduisant l'énergie d'activation, ce qui entraîne des temps de réaction plus rapides et des rendements plus élevés.
● Sélectivité : Ses fortes propriétés acides garantissent que seuls des substrats spécifiques sont activés, offrant une sélectivité élevée dans les réactions complexes.
● Polyvalence : Il peut être utilisé dans une large gamme de réactions, notamment la synthèse organique, la polymérisation et les processus électrochimiques.
4.2 Défis
● Corrosivité : En raison de sa forte nature acide, l’acide borofluorique est hautement corrosif et nécessite une manipulation et un équipement spécialisés.
● Impact environnemental : En tant que composé contenant du fluor, l’acide borofluorique et ses dérivés doivent être éliminés avec précaution pour éviter toute contamination de l’environnement.
● Coût : La production et la purification de l’acide borofluorique peuvent être coûteuses, ce qui limite son utilisation dans les processus industriels à grande échelle.
L'acide borofluorique est un catalyseur incroyablement polyvalent qui joue un rôle essentiel dans la synthèse des sels de borofluorure, la synthèse organique, la polymérisation et les applications électrochimiques. Sa capacité à agir à la fois comme acide de Brønsted et de Lewis en fait un outil indispensable dans de nombreux processus chimiques. Cependant, son utilisation nécessite une manipulation prudente en raison de sa nature corrosive et de son impact environnemental. Grâce aux recherches en cours et aux avancées technologiques, l'acide borofluorique est susceptible de trouver encore plus d'applications dans diverses industries, favorisant l'innovation et l'efficacité dans un large éventail de secteurs.




